王则柯 | 市场经济理念的本土思想资源
蛋白质的误折叠与集聚除了是分子生物学里面尚存的重大基础科学问题以外,它还涉及许多人类的致命疾病,例如阿尔茨海默氏病(AD),亨廷顿氏病(HD),帕金森氏病(PD)和疯牛病等。许多前期研究表明错折叠的β-淀粉样肽在此类疾病中起关键作用。当β-淀粉样蛋白肽错误折叠时,它们可能积聚为原纤维和噬菌斑。但是,Dobson及其同事开创的最新实验表明,在适当的条件下,几乎任何蛋白质都可以形成淀粉样蛋白和原纤维,而溶菌酶就是其中一个很好的例子。这一发现表明,还有许多其他的由突变引起的误折叠与集聚的例子,对其进行深入探索可以了解由蛋白质误折叠引起的疾病的机理。
(1) 溶菌酶
在该项目中,我们使用MD模拟研究了单点突变(W62G)如何影响蛋清溶菌酶蛋白的稳定性和误折叠。我们通过蓝色基因 BlueGene 超级计算机,模拟了野生型和突变型溶菌酶。我们的结果表明,该突变体的结构确实比野生型稳定得多,这与最近的溶菌酶在尿素中结构变性实验是一致的,并且为溶菌酶蛋白误折叠和随后聚集的机制提供了有用的启发。
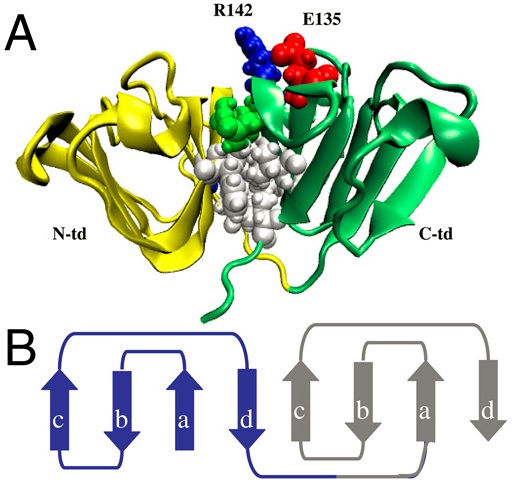
人类γD晶状体蛋白是晶状体中含量第三高的γ-晶状体蛋白,并且是老年性白内障的重要组成部分。由于眼晶状体的一体性,很难在人体环境中中表征白内障的发生。由于实验复杂性,尚未实现对晶状体纤维细胞或完整晶状体内聚集前体状态的直接鉴定。在这项研究中,我们使用了广泛的原子分子动力学模拟来表征人γD晶状蛋白的解折叠,然后进行聚集。该观察结果与当前的白内障发生模型一致。绘制结晶蛋白聚集的初始途径,可以为靶向搜索抑制多种蛋白质沉积疾病(包括白内障形成的蛋白质)的药物设计提供途径。
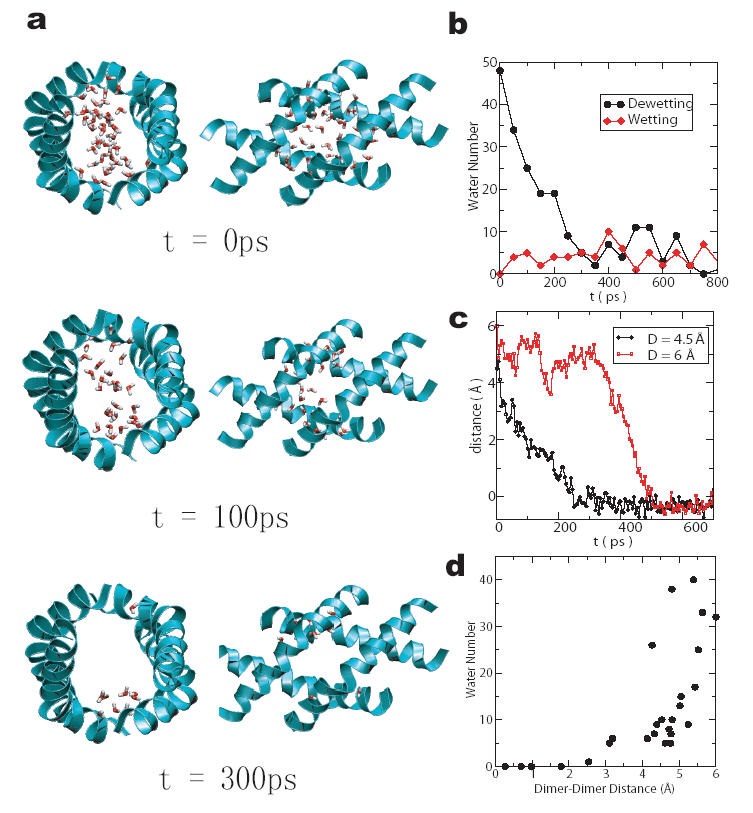
疏水性被认为是蛋白质折叠的主要驱动力,这一过程仍然是一个谜。了解疏水性塌陷的性质是解决蛋白质折叠问题的重要一步。对于简单的纳米级溶质,例如石蜡板,疏水性在彼此接近的疏水性表面之间的间隙中引起强烈的干燥过渡。该转变虽然发生在微观尺度,但类似于从液体到蒸气的一阶相变。我们试图在这个项目中解决的问题是,当蛋白质折叠或形成大型的多蛋白质复合物时,是否会发生类似的去湿转变,如果发生的话,物理相互作用决定着去湿的临界距离以及崩解速度。如此深入的了解可能有助于(1)设计新颖的水纳米孔(类似于膜蛋白Aquaprion);(2)设计纳米级分子开关;(3)更好地了解所有亚细胞自组装的机制。
令我们惊讶的是,我们最近在蛋白质蜂毒肽四聚体的纳米级通道内观察到了如此显着的去湿过渡。Melittin是26个残基的多肽,是一种在蜜蜂毒液中发现的小毒性蛋白,通常会自组装成四聚体。强的去湿过渡发生在亚纳秒级的时间尺度和亚纳米级(最大2-3个水直径)的长度尺度中。还发现去湿转变对三个非常疏水的氨基酸(异亮氨酸)向较少疏水残基的单突变非常敏感。正确位置的此类突变可将通道从干燥切换为潮湿-“分子切换”。因此,疏水性表面拓扑的相当细微的变化会对干燥转变产生显着影响。这项研究表明,即使存在极性蛋白质骨架,足够疏水的蛋白质表面也可以诱导液-汽转变,从而为进一步的崩塌提供巨大的驱动力。我们的早期研究还表明,与理想的纳米级疏水性板相比,发现蛋白-水静电相互作用是造成多域蛋白塌陷慢得多的主要原因,而范德华相互作用在很大程度上决定着较小的反润湿临界距离。
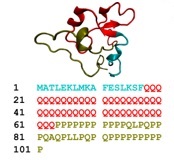
亨廷顿舞蹈病(HD)是由亨廷顿基因(Htt)的第一个外显子中核苷酸CAG重复序列的突变延伸引起的,该序列编码一个细长的聚谷氨酰胺(polyQ)。成人亨廷顿舞蹈病发作的致病性阈值Q长度在36到40之间,CAG重复次数少的个体没有HD疾病。小鼠模型以及体外实验也证实了Htt中增加的CAG重复与HD的发展之间的密切相关性。尽管在polyQ的长度和HD的发病年龄之间建立了公认的负相关性,但扩展的polyQ束引起神经元功能障碍并导致细胞死亡的机制仍不清楚。因此,对polyQ长度如何影响Htt蛋白结构,动力学及其与他人相互作用的系统研究至关重要。我们目前正在使用具有各种polyQ长度的Htt的完整外显子1进行广泛的全原子分子动力学(MD)模拟,以研究可能触发的wtHtt(Q22)和mtHtt(其他Q长度)的结构和聚合物性质HD相关蛋白聚集体的形成。
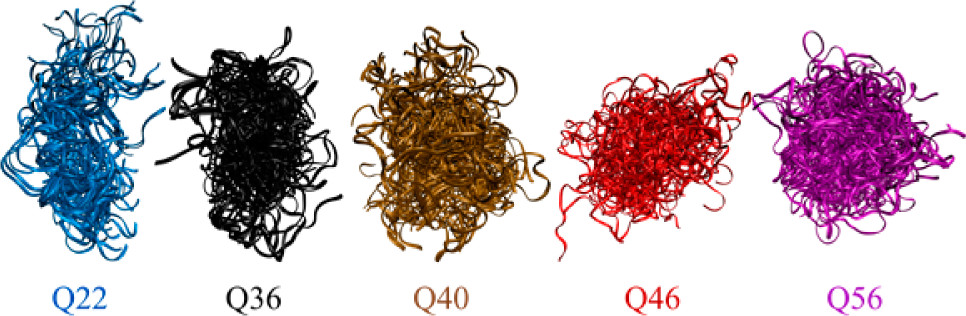
我们应用广泛的分子动力学模拟研究Htt-exon-1在5个不同polyQ长度上的折叠。我们发现,在更长的Q长度处,二级结构基序增加,包括β-折叠含量似乎有助于形成越来越紧凑的结构。更引人注目的是,这些更长的Q长度采用了超紧凑的结构,旋转半径和Q长度之间的幂律缩放指数(0.22)令人惊讶地证明了这一点,该指数大大低于紧凑球状结构的预期值(〜0.33)和非结构化蛋白质(约0.50)。氢键分析进一步表明,polyQ的超紧凑行为主要是由于谷氨酰胺侧链的“胶状”行为,其侧链-侧链的H键比蛋白质数据库(PDB)中的普通蛋白质多得多。谷氨酰胺侧链的取向也倾向于被“掩埋”在内部,这解释了为什么polyQ结构域自身不溶。
P. Das, J. A. King, and R. H. Zhou,
Aggregation of Partially Folded gamma-Crystallin Associated with Human Cataracts via Domain Swapping at the C-terminal beta-strands,
Proc. Natl. Acad. Sci., 108, 10514-10519, 2011 (featured article)
R. H. Zhou, M. Eleftheriou, A. Royyuru, B. J. Berne,
Destruction of long-range interactions by a single mutation in lysozyme,
Proc. Natl. Acad. Sci., 104, 5824-5829, 2007
P. Liu, X. Huang, R. Zhou and B. J. Berne,
Drying and Hydrophobic Collapse of Melittin Tetramer,
Nature, 437, 159-162, 2005
R. Zhou, X. Huang, C. Margulius and B. J. Berne,
Hydrophobic Collapse in Multi-domain Protein Folding,
Science, 305, 1605-1609, 2004